Melody Di Bona: da UniGe alla copertina di Science
Pubblicato su Science (ed. 30 agosto 2024) il paper di Melody Di Bona, attualmente postdoc al Memorial Sloan Kettering Cancer Center di New York, laureata magistrale e dottore di ricerca UniGe.
Utilizzando microscopia e spettroscopia avanzate, la ricerca ha dimostrato che i radicali liberi sono la causa del collasso dei micronuclei e che l'uso di antiossidanti riduce tali eventi di collasso ma anche i riarrangiamenti cromosomici che sono alla base della metastatizzazione dei tumori definiti "aggressive".
Quanto scoperto è ritenuto dalla comunità scientifica un passo avanti importante nella comprensione del processo che porta alla formazione e allo sviluppo dei tumori, tanto da portare la ricerca sulla copertina della rivista.

Numerosi tipi di tumore sono caratterizzati da instabilità cromosomica, che è un difetto nel processo di divisione mitotica: la ridistribuzione dei cromosomi tra le cellule figlie durante la divisione cellulare può comportare la "perdita" di un cromosoma che, al termine del processo di mitosi, con la formazione di nuove cellule, invece di convogliare con gli altri cromosomi nel nucleo, viene incapsulato in un micronucleo. Ma i micronuclei sono molto diversi dal nucleo primario: presentano difetti funzionali e strutturali e, cosa estremamente rilevante, sono spesso e facilmente soggetti a rottura. Questo punto è cruciale perché rompendosi i micronuclei rilasciano DNA nel citosol, dove non solo si frammenta e si riarrangia in maniera anomala, ma viene anche riconosciuto da enzimi che iniziano un signaling che porta a metastasi, resistenza alla terapia ed evasione del sistema immunitario. Per i pazienti, tutto ciò si traduce in un peggioramento della prognosi.
Perché e come, esattamente, si rompono i micronuclei? La risposta a questa domanda è arrivata con la ricerca di Melody Di Bona, attualmente postdoc al Memorial Sloan Kettering Cancer Center di New York (USA), laureata magistrale e dottore di ricerca UniGe.

Nell'articolo pubblicato sull'edizione del 30 agosto 2024 di Science, una delle più prestigiose e influenti riviste scientifiche internazionali, Di Bona ha svelato il "mistero" grazie all’uso della microscopia ottica a fluorescenza e dei concetti di biofisica appresi durante il dottorato all'Università di Genova con Alberto Diaspro: la super-risoluzione ha permesso di scoprire che i micronuclei rotti sono circondati da molti più mitocondri rispetto a quanto si osserva per i micronuclei intatti. I mitocondri producono ATP, possono essere considerati "le centrali energetiche" della cellula, ma producono anche i radicali liberi; queste molecole altamente reattive ossidano le proteine del micronucleo, compromettendo i meccanismi di trasporto all'interno di questi organelli. Ciò causa l’accumulo di una proteina chiamata CHMP7, che, in teoria, dovrebbe riparare la membrana nucleare ma, nei micronuclei in condizioni di stress ossidativo, polimerizza e forma degli aggregati che, legandosi strettamente alla membrana del micronucleo, la tirano verso l’interno accartocciandola fino alla sua rottura. Sempre grazie alla microscopia, Di Bona è riuscita a quantificare questa deformazione, correlandola con la presenza di CHMP7 e con la vicinanza di mitocondri. Non solo: con la collaborazione di un altro alumnus di Alberto Diaspro, Lorenzo Scipioni, ora group leader al Centre de recherche en cancerologie de Toulouse (Francia), sono stati realizzati esperimenti di fotobleaching (una tecnica spettroscopica per studiare la diffusione di proteine) e di diffusione proteica con cui è stato dimostrato che i radicali liberi aumentano l’aggregazione di CHMP7 e il suo accumulo nel micronucleo.
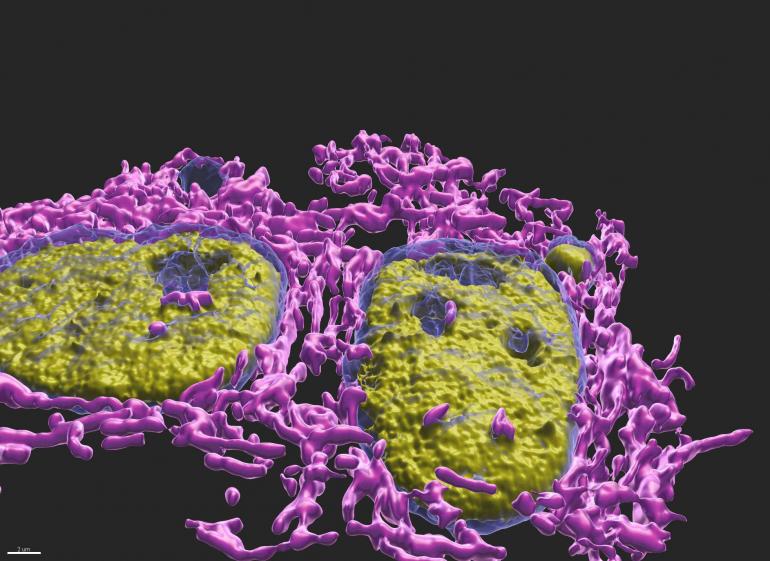
Sono visibili due micronuclei, uno rotto e uno intatto.
Quanto scoperto è di fondamentale importanza nella battaglia contro il cancro perché, come è stato dimostrato, si tratta di un meccanismo estremamente rilevante in condizioni di ipossia, ovvero concentrazioni limitate di ossigeno, comune a quasi tutti i tipi di tumore solido. L'utilizzo di antiossidanti ha permesso ai ricercatori di prevenire la rottura dei micronuclei anche in condizioni ipossiche, e con essa i riarrangiamenti cromosomici che ne seguono e che hanno un effetto così negativo sulla prognosi dei pazienti.
La speranza è che questa ricerca apra la strada a nuove terapie che possano sfruttare antiossidanti (che non sono sempre benefici, ma vanno usati con cautela), contestualizzandoli nell’ambito del trattamento dei tumori di tipo avanzato.

