Un passo in avanti nella comprensione delle cause delle malattie parossistiche genetiche dell’infanzia
Identificato un nuovo meccanismo alla base delle patologie causate dalla mutazione del gene PRRT2
La mutazione del gene PRRT2, che codifica una proteina specifica per i neuroni, causa l’insorgenza di diverse malattie neurologiche di tipo parossistico, quali epilessia benigna infantile, discinesia parossistica chinesigenica, emicrania emiplegica e atassia episodica. Queste diverse patologie possono presentarsi nei pazienti isolatamente o associate.
I ricercatori del Centro di Neuroscienze e Tecnologie Sinaptiche dell’Istituto Italiano di Tecnologia presso l’IRCCS Ospedale Policlinico San Martino e del Dipartimento di Medicina Sperimentale dell’Università di Genova, guidati da Fabio Benfenati e Pietro Baldelli, sono da anni impegnati nello studio dei meccanismi alla base delle patologie parossistiche associate a mutazioni di PRRT2.
Recentemente i loro studi hanno portato ad una nuova scoperta, dimostrando come la mutazione di PRRT2 altera l'azione dello ione calcio, fondamentale per il corretto funzionamento delle sinapsi chimiche attraverso cui i neuroni comunicano tra loro. I risultati di questo studio, pubblicati sulla prestigiosa rivista internazionale Cell Reports [1] e finanziati da Fondazione Telethon, Compagnia di San Paolo e il progetto europeo Horizon 2020 Snareopathies, potrebbero portare allo sviluppo di nuove strategie terapeutiche per contrastare più efficacemente le patologie associate alle mutazioni del gene neuronale PRRT2.
La complessa sindrome neurologica causata dalla mutazione di PRRT2
Ad oggi, sono stati segnalati oltre 1500 pazienti con 70 diverse mutazioni nel gene PRRT2, sebbene la quasi totalità dei pazienti presenti la stessa identica mutazione che comporta l'inserimento di un precoce segnale di stop nel gene, provocando la mancata sintesi o la perdita prematura della proteina codificata dal gene stesso. Questo causa insufficienti livelli di espressione della proteina PRRT2 che diventa totalmente assente nei rari pazienti nei quali entrambi i geni sono mutati [2].
Gli studi hanno evidenziato come l’eredità di questi disturbi sia dominante con un rischio di ricorrenza nel 50% dei figli di una persona che ha presentato manifestazioni simili ed è portatrice del gene mutato. Queste condizioni possono però comparire anche in un individuo in cui nessun genitore ha mai manifestato disturbi simili e in cui la mutazione si è generata «de novo», per la prima volta nella famiglia.
I principali disturbi neurologici associati alla presenza della mutazione di PRRT2, ovvero epilessia, discinesia parossistica ed emicrania emiplegica possono comparire in momenti diversi dell’infanzia del paziente. Ad esempio, le crisi epilettiche si verificano tipicamente entro i primi due anni di vita, la discinesia parossistica è più frequente in età scolare, mentre l’emicrania emiplegica, evenienza più rara, compare in genere più tardivamente. Mentre la sintomatologia delle crisi epilettiche è ampiamente conosciuta quella degli altri due disturbi necessita di una breve descrizione. La discinesia parossistica chinesigenica è tipicamente scatenata da un movimento volontario o dall’esercizio fisico e si manifesta con contrazioni involontarie che rendono il movimento del soggetto impacciato o addirittura impossibile. L’emicrania emiplegica, invece, si presenta come una cefalea di forte intensità che può essere accompagnata da un disturbo neurologico transitorio come paresi di un lato del corpo o blocco della parola. Queste tre condizioni compaiono sotto forma di attacchi improvvisi di durata variabile da qualche minuto a poche ore con tendenza a ripetersi, costituendo pertanto un serio problema per i pazienti e le loro famiglie.

La mutazione del gene PRRT2 altera l'azione dello ione calcio a livello sinaptico
Fino al 2012 la funzione della proteina codificata dal gene PRRT2 era totalmente sconosciuta. L'interesse per questo gene è improvvisamente aumentato quando il sequenziamento di nuova generazione, combinato con l'analisi di linkage classica, ha permesso l'identificazione di una serie di mutazioni del gene PRRT2 come la principale causa delle patologie neurologiche descritte.
A partire da quegli anni, numerosi gruppi di ricerca hanno iniziato a studiare le basi genetiche di questo gruppo eterogeneo di malattie tentando di dedurre, dalle disfunzioni del sistema nervoso centrale causate dalla carenza o assenza di PRRT2, il ruolo della proteina nello sviluppo, attività e plasticità delle reti neuronali.
Recentemente il gruppo di ricerca dell’IIT e dell’Università di Genova, in collaborazione con l’Istituto Gaslini, aveva scoperto che la proteina PRRT2 agisce come inibitore della funzione dei canali ionici per il sodio responsabili della generazione del potenziale d’azione, il segnale elettrico che denota l’eccitazione neuronale. In assenza di PRRT2, i canali sodio divengono più attivi, rendendo i circuiti nervosi meno stabili e più eccitabili [3,4].
In questo nuovo studio i ricercatori dell’IIT e dell’Università di Genova hanno identificato uno specifico coinvolgimento dei canali sinaptici per il calcio nelle patologie legate a PRRT2 [1]. Questi canali sono espressi nelle terminazioni assoniche che formano il lato presinaptico, specializzato nel rilascio di neurotrasmettitore. Il calcio che entra attraverso tali canali innesca l’esocitosi delle vescicole sinaptiche contenenti il neurotrasmettitore attivando quindi la trasmissione dell’informazione a livello della sinapsi.
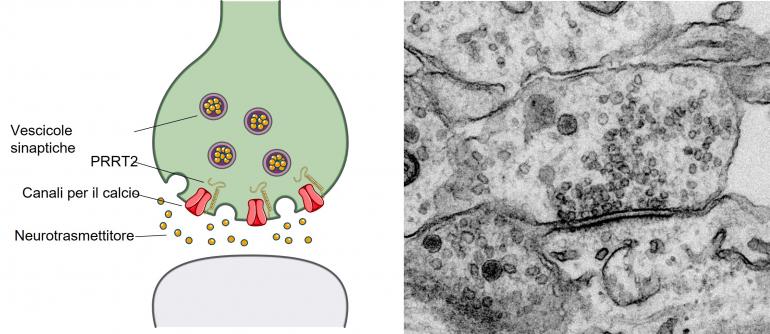
I risultati ottenuti hanno dimostrato che, nei pazienti con mutazioni del gene PRRT2, i neuroni divengono incapaci di concentrare correttamente i canali del calcio a livello delle sinapsi, compromettendo la loro capacità di rilasciare il neurotrasmettitore. L’identificazione di questo nuovo ruolo della proteina sinaptica PRRT2 contribuisce ulteriormente a chiarire come le mutazioni del gene PRRT2 siano in grado di destabilizzare l’attività dei circuiti nervosi, portando all’insorgenza delle manifestazioni parossistiche [1].
Oltre ad accrescere la conoscenza sulla funzione della proteina PRRT2 nella trasmissione sinaptica, questa scoperta identifica i canali per il calcio come un promettente bersaglio terapeutico per le patologie parossistiche causate da carenza di PRRT2. Questi risultati testimoniano l’importanza della ricerca preclinica in Neuroscienze come un passo cruciale per l’individuazione di strategie terapeutiche per complesse patologie genetiche volte a curare la causa della malattia, più che a correggerne solo i sintomi. Solo una completa comprensione dei meccanismi patogenetici alla base delle complesse malattie del sistema nervoso può permettere, nel vicino futuro, di migliorare e personalizzare le strategie terapeutiche per un miglioramento della qualità della vita dei pazienti.
Bibliografia essenziale
1. Ferrante D, Sterlini B, Prestigio C, Marte A, Corradi A, Onofri F, Tortarolo G, Vicidomini G, Petretto A, Muià J, Thalhammer A, Valente P, Cingolani LA, Benfenati F, Baldelli P. PRRT2 modulates presynaptic Ca2+ influx by interacting with P/Q-type channels. Cell Reports 2021 Jun 15;35(11):109248. doi:10.1016/j.celrep.2021.109248;
2. Valtorta F, Benfenati F, Zara F, Meldolesi J. PRRT2: from paroxysmal disorders to regulation of synaptic function. Trends in Neuroscience 2016 Oct;39(10):668-679. doi: 10.1016/j.tins.2016.08.005;
3. Fruscione F, Valente P, Sterlini B, Romei A, Baldassari S, Fadda M, Prestigio C, Giansante G, Sartorelli J, Rossi P, Rubio A, Gambardella A, Nieus T, Broccoli V, Fassio A, Baldelli P, Corradi A, Zara F, Benfenati F. PRRT2 controls neuronal excitability by negatively modulating Na+ channel 1.2/1.6 activity. Brain 2018 Apr 1;141(4):1000-1016. doi: 10.1093/brain/awy051;
4. Valente P, Romei A, Fadda M, Sterlini B, Lonardoni D, Forte N, Fruscione F, Castroflorio E, Michetti C, Giansante G, Valtorta F, Tsai JW, Zara F, Nieus T, Corradi A, Fassio A, Baldelli P, Benfenati F. Constitutive Inactivation of the PRRT2 gene alters short-term synaptic plasticity and promotes network hyperexcitability in hippocampal neurons. Cerebral Cortex 2019 May 1;29(5):2010-2033. doi: 10.1093/cercor/bhy079.
Fabio Benfenati è Professore ordinario di Fisiologia Umana presso il DIMES e Direttore del Centro di Neuroscienze e Tecnologie Sinaptiche dell’IIT.
Pietro Baldelli è Professore ordinario di Fisiologia Umana presso il DIMES e ricercatore affiliato al Centro di Neuroscienze e Tecnologie Sinaptiche dell’IIT.