Un modello predittivo dello sviluppo del COVID-19
Facciamo chiarezza su Coronavirus e COVID-19
Un nuovo Coronavirus epidemico/pandemico si è affacciato a ottobre-novembre 2019 nella regione dello Hubei in Cina. Il virus, denominato definitivamente SARS-CoV.2 dall’organo internazionale scientifico competente (ICTV - International Committee on Taxonomy of Viruses) e COVID-19 (che definisce la malattia) dall'Organizzazione Mondiale della Sanità, ha grande genoma a RNA(30Kb), pericapside, simmetria icosaedrica, si trasmette per via aerea o tramite mani portate alla bocca in seguito alla sua resistenza sulle superfici in presenza di acqua e proteine (come nei droplet).
Giunto in Europa almeno il 21 gennaio 2020 (in Germania, NEJM), e in Italia immediatamente dopo, è accertato che il virus abbia un’elevata contagiosità con un fattore di contagio (frequenza di contagio * n. di contatti) R0=3 equivalente alla trasmissione al 60% dei contatti.
Sintomi, caratteristiche e gravità
SARS-CoV.2 causa una malattia paucisintomatica nell’80% dei casi (congiuntivite, sindrome simil-influenzale, diarrea, mal di gola con febbre 37,5-38,5°C), oltre a una considerevole base di infezioni asintomatiche pur sempre infettanti per soggetti suscettibili. Nel 20% dei casi la malattia progredisce alle basse vie aeree, con insufficienza respiratoria progressiva, necessità di O2-terapia standard, poi di ventilazione non invasiva e infine di respirazione in UTI (Unità di Terapia Intensiva) con respiratori dove il numero di ricoveri fra gli infetti è stimato intorno al 5-12%.
La gravità della malattia è massima in età >70-90 anni, in presenza di altre malattie (BPCO, diabete, insufficienza renale, cardiopatie) con letalità >15%, mentre è meno letale in età infantile (<0,1%), nel giovane adulto (0,1-1%) e nell’adulto (2-5%).
Si tratta di virus con letalità maggiore alle pandemie influenzali (letalità globale ca. 3% vs. 0,1%) e diffusibilità molto superiore (60-70% vs. 20%).
La letalità spaventa ma non è il problema principale
Il problema principale medico non è posto dalla letalità, ma dalla diffusibilità che genera un sovraccarico in operatori e strutture con l’improvviso affiorare di un elevatissimo numero di pazienti con necessità di ossigenoterapia semi-intensiva (20% degli infetti sintomatici) e di UTI con intubazione (5-12% degli infetti sintomatici).
Non esiste al momento un antivirale specifico, ma solo la terapia eterotipica con farmaci sperimentali non disponibili su larga scala (Remdesivir) o con altri farmaci che vengono usati con evidenze in vitro o episodiche (diidrossiclorochina, darunavir/ritonavir), come pure antiinfiammatori eterotipici (tocilizumab, anti-IL-6Receptor).
Di fronte a una tale situazione diviene pertanto necessario capire la dinamica dell’epidemia per attuare tempestivamente le misure di contenimento e controllo necessarie.
I modelli di simulazione
Sebbene esista un’ampia letteratura scientifica sullo sviluppo delle epidemie, la maggioranza dei modelli esistenti assume che i parametri caratteristici dell’epidemia siano noti e stabilizzati.
Adottare questi modelli a epidemia conclusa risulta un interessante esercizio di ricostruzione a posteriori ma di scarsa utilità mentre l’epidemia evolve nelle prime cruciali settimane, quelle che determinano la capacità del sistema-Paese di rispondere più o meno efficacemente in termini di misure di contenimento e controllo, arrivando all’isolamento di porzioni della popolazione, allestendo nuove Unità di Terapia Intensiva o Media Intensità (UTI/UMI), giocando su quell’anticipo temporale che si misura in qualche settimana.
Alternativamente, l’utilizzo di modelli basati semplicemente su curve di tendenza estrapolate dai dati storici, seppur diffuso e pubblicato soprattutto in queste ultime settimane, risulta decisamente impreciso e fornisce risultati con tale ampiezza di errore (al solo variare dei dati reali degli ultimi due giorni rispetto ai precedenti) da rendere l’esercizio inutile o addirittura dannoso.
Esiste una terza via che è quella adottata da un gruppo di esperti dell’Università di Genova, gruppo composto da tre competenze interdisciplinari di virologia e malattie infettive (Prof. Andrea De Maria), modellazione e simulazione di sistemi complessi per la gestione di attività operative (Prof. Flavio Tonelli), informatica computazionale (Dott. Agostino Banchi, unico membro del gruppo esterno all’Ateneo ligure ma con elevata competenza di analisi e sviluppo del modello software) insieme ad altri colleghi che hanno contribuito alla validazione del modello di simulazione e delle ipotesi su cui si basa (Prof. Federico Scarpa e Prof. Vittorio Sanguineti).
Ipotesi, deduzione, abduzione, simulazione
Il tempo è la risorsa più scarsa durante uno sviluppo epidemico repentino; se il pensiero ipotetico-deduttivo non risulta adeguato, la capacità di ragionare in modo abduttivo permette di fronteggiare, su un piano evolutivo, condizionamenti e vincoli, anche in rapido cambiamento, considerando i dati noti e arrivando a comprendere le dinamiche che li hanno generati.
Il nesso tra abduzione e simulazione si colloca in una prospettiva di ‘quasi-deduzione’: i risultati sono validati empiricamente considerando che tutte le successive osservazioni confermano il ragionamento effettuato. Questo approccio offre il vantaggio della sinteticità e della rapidità, insieme alla sua efficacia.
Modello di simulazione: come funziona
Il modello di simulazione deduttivo-empirico sviluppato è in grado di riprodurre l’evoluzione nel tempo delle condizioni ogni singolo individuo sulla base di parametri variabili quali:
- la data di inizio dell’epidemia
- la capacità di contagiare altri soggetti (denominata R0) temporalmente traslati su UTI e UMI
- la mortalità/letalità
- i giorni necessari per l’incubazione
- i giorni di degenza
- il numero di casi gravi (quelli che presumibilmente saranno gestiti in UTI) rispetto agli infetti
- la distribuzione di probabilità che il decesso avvenga (a seguito di complicazioni) in un certo periodo di tempo
- i giorni necessari per la guarigione
da una data di inizio e ricostruendo il percorso dell’individuo in interazione e contatto con altri individui, calcolando per ogni giorno le percentuali dei contagiati, il processo di incubazione, l’eventuale aggravarsi fino al ricorso dell’UTI/UMI, non partendo dal dato sugli infetti/tamponati ma da quello che viene definito ‘effetto ghost’ e utilizzando come variabili di ‘calibrazione’ i dati certi di utilizzo delle UTI e il numero di decessi.
Il modello stocastico lavora con variabili aleatorie in grado di cogliere l’incertezza dei processi reali tenendo conto della loro probabilità.
L’approccio costruttivo del modello numerico permette di variare nel tempo tutte le grandezze parametriche in gioco e di tener conto, su giorni diversi, dell’aspettativa d’efficacia delle misure di contenimento e controllo sulla distanza sociale tra gli individui, andando quindi a ipotizzare valori diversi per R0, modellabili come una curva di R0 di ‘input’ (parte dei quali calibrati sui dati storici disponibili) che permette di valutare gli effetti sulla dinamica del modello.
Sperimentazione del modello - febbraio 2020
La prima sperimentazione dell’approccio, condotta nel mese di febbraio 2020 sui dati provenienti dalla Cina (Hubei) , ha prodotto risultati rilevanti con un errore medio di predizione, negli ultimi 10 giorni di febbraio, che si assestava sempre e comunque sotto al 5-7%.
Diversi parametri, in quella prima simulazione, sono stati volontariamente forzati con valori diversi rispetto a quelli comunicati dalle Autorità Competenti (anche OMS); i valori assunti nella simulazione sono stati poi confermati, verso fine febbraio, da parte delle autorità competenti. In particolare, il gruppo di ricerca ‘calibra’ l’algoritmo con assunzioni che al 7 febbraio 2020 potevano sembrare difformi rispetto ai dati ufficiali:
- data di inizio epidemia a fine novembre 2019 anziché primo gennaio 2020
- fattore di riproduzione R0 = 2,8 (anziché il valore R0 = 1,5-2 originariamente stimato da OMS)
- mortalità presunta intorno al 3,7%, pur consapevoli degli problemi di conteggio dei positivi reali a causa dell’effetto ghost (incluso nel modello) che probabilmente erano al tempo 3 o 4 volte superiori a quanto identificato
- efficacia delle misure attuate in Cina a regime in grado di ridurre il fattore di riproduzione a R0 = 0,30-0,35
A oggi le principali riviste scientifiche del settore, come ad esempio Lancet, hanno riconosciuto per la Cina praticamente questi stessi valori.
Lo stesso approccio è stato quindi applicato a partire dal 16 febbraio 2020 ai primi casi in Italia con alcune assunzioni:
- andamento di R0 con valori iniziali più alti per tenere conto delle diverse abitudini sociali degli italiani, ivi compreso la non osservanza delle regole (i.e. week-end del 7-8 Marzo)
- mortalità più elevata in misura alla maggiore età media del contesto Italia (Cina 46 anni)
- una migliore e più aderente logica di utilizzo delle terapie intensive
- una data di inizio, almeno in questo caso, nota sin dal principio
Questo permette, già il 26 febbraio, di stimare i primi effetti di sovraccarico delle UTI/UMI italiane segnalando un certo livello di saturazione attesa delle UTI entro la fine della prima settimana di marzo per l’area Lombardia.
Calcolo predittivo - marzo 2020
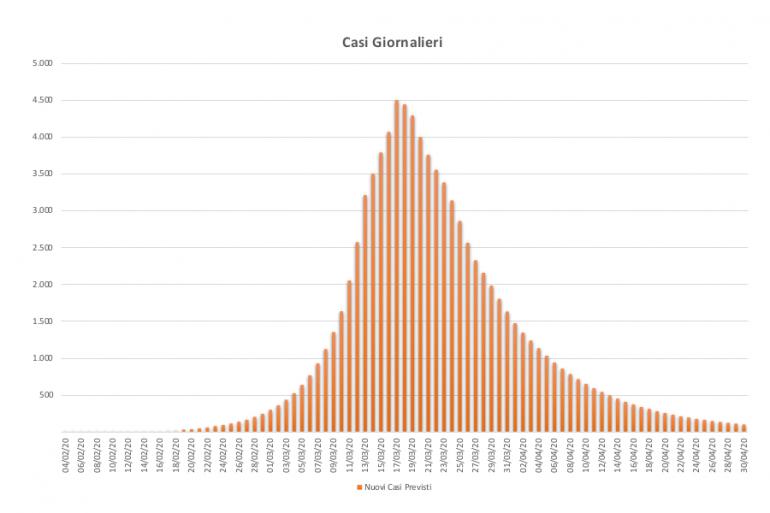
Nei primi giorni di marzo il modello numerico permette di simulare la proiezione dell’intera epidemia sull’Italia (fino a fine aprile) generando diversi scenari che, a oggi hanno, avuto un errore medio di previsione tra il 7-9% e in particolare:
- curva dei contagiati totali = 8,82%
- curva degli infetti nel tempo = 7,96%
- curva dei decessi totali = 3,29%
- curva degli utilizzanti UTI = 5,53%
- curva dei guariti totali = 9,49%.
Nel frattempo le autorità competenti governative hanno iniziato ad applicare le misure di contenimento e poi di controllo.
Gli scenari possibili
Considerando l’ipotesi governativa circolata come base per la Ragioneria di Stato che è stata assunta come scenario BASE sono stati elaborati altri due scenari riassumibili in:
- SCENARIO BASE – parametri che ricostruiscono le curve utilizzate da Ragioneria di Stato per procedura richiesta risorse in divergenza da Patto di Stabilità
- SCENARIO PEGGIORATIVO – inosservanza parziale delle misure fino al 24 marzo 2020 poi incremento dell’osservanza ‘dettata da controlli e nuove misure’ e aumento delle UTI destinate al COVID-19 fino a 2.500 – definito fase1
- SCENARIO MIGLIORATIVO – misure pienamente rispettate dal 12 marzo 2020 e incremento di controlli e misure il 20 marzo, con aumento delle UTI COVID-19 a 2500 – definito fase 2
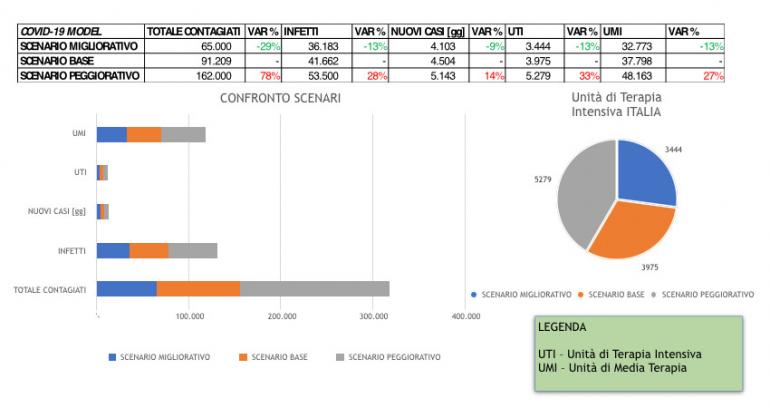
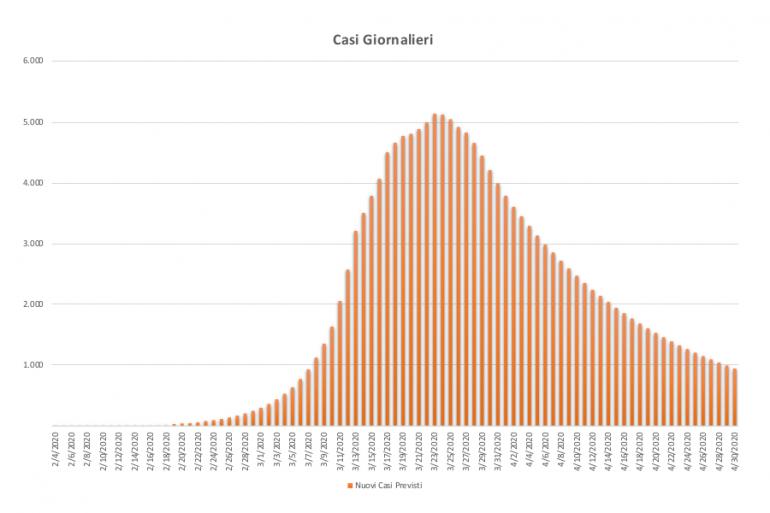
Si può notare come variazioni comportamentali e misure di contenimento presentino variazioni percentuali piuttosto rilevanti e di cui preoccuparsi, soprattutto alla luce delle necessarie riorganizzazioni delle UTI e delle UMI che potrebbero vedere un picco di oltre 5.000 richieste per le UTI e di quasi 50.000 per le UMI nel caso di scenario peggiorativo. Per contro, un’azione di maggiore controllo e contenimento potrebbe portare a una riduzione di entrambe le criticità (3500 UTI e 33.000 UMI) entro valori ancora gestibili dal nostro Sistema Sanitario Nazionale.
Il modello di simulazione è utile anche per considerare gli effetti di una distribuzione a “ping-pong” (fra emisfero sud e nord del pianeta e fra paesi a diversa sincronia pandemica) che possa condurre al possibile ripresentarsi del virus nella prossima stagione autunnale.
Infine, le voci sulla prossima disponibilità di uno strumento vaccinale, proveniente da USA, Cina, Israele ecc., devono essere considerate con estrema cautela: un vaccino deve essere accuratamente validato per verificare che stimoli risposte immuni, che queste siano protettive nell’animale e in seguito nell’uomo. Questi processi necessitano di almeno 18 mesi di tempo, nella migliore delle ipotesi.
