Acts of Light: nuove strategie per la attivazione neuronale mediante la luce
Lectio in occasione del Cesare Casella Prize 2020, 18 novembre 2020. Almo Collegio Borromeo, Pavia
In più sereno Splendore, in più dorata luce, vedo
Ogni piccolo dubbio e paura, ogni piccola discordia di quaggiù, sparita.
Emily Dickinson, Acts of light
Da questa poesia di Emily Dickinson e dalla omonima famosa coreografia di Martha Graham ad essa ispirata emerge l’idea che la luce è l’energia che alimenta la vita sul nostro pianeta.
Gli organismi più semplici, come batteri, alghe o funghi unicellulari, hanno messo a punto strategie per tradurre gli stimoli luminosi in variazioni del loro metabolismo al fine della loro sopravvivenza nell’ambiente. Tali organismi hanno sviluppato sensori-attuatori di membrana (opsine microbiche) costituite da canali o pompe ioniche che, attivate dalla luce, generano variazioni nello stato elettrico della membrana.
Negli organismi superiori, questi sensori si sono sviluppati in maniera ristretta in una categoria di neuroni altamente specializzati, i fotorecettori della retina, mentre tutto il resto del cervello non è sensibile alla luce.
Una recente branca delle Neuroscienze, l’optogenetica, nata nel 2005 ad opera di Karl Deisseroth a Stanford, ha introdotto le opsine microbiche nei neuroni dei mammiferi, riuscendo a comandare la loro attività elettrica mediante radiazioni luminose. Rispetto alla stimolazione elettrica, questa tecnica innovativa si è dimostrata molto più specifica, ma richiede la trasformazione genica dei neuroni con DNA esogeno. Negli ultimi anni abbiamo sviluppato interfacce “opto-neurali” con materiali fotosensibili per modificare l'attività elettrica dei neuroni con la luce senza modificarli geneticamente utilizzando sia polimeri coniugati fotovoltaici e sia molecole fotocromatiche che con meccanismi diversi sono in grado di fotoeccitare i neuroni.

Dai polimeri alle retine artificiali
I polimeri coniugati, come il politiofene P3HT, analogamente alle celle solari basate sulla tecnologia del silicio, generano separazione di cariche quando assorbono i fotoni e si caricano negativamente sulla superficie.
Questo meccanismo non è molto dissimile dal funzionamento dei fotorecettori retinici che convertono il segnale luminoso in un segnale elettrico per i circuiti retinici e potrebbe essere vantaggiosamente applicato per correggere l’ipovisione provocata da neurodegenerazione dei fotorecettori.
Rispetto agli esistenti approcci neuroprotesici per la cecità degenerativa, la retina artificiale “polimerica” mostra elevata biocompatibilità (i polimeri coniugati sono polimeri del carbonio simili a proteine, carboidrati e acidi nucleici), alta conformabilità meccanica e sensibilità alla luce nell’ambito di intensità della luce diurna.
Sulla base di queste caratteristiche, abbiamo sviluppato un dispositivo fotoattivo completamente organico e lo abbiamo impiantato al di sotto della retina in un modello sperimentale di Retinite pigmentosa (ratti Royal College of Surgeons), osservando un consistente recupero delle funzioni visive (Nature Materials 2017, 16: 681-689). Tuttavia, la copertura retinica da parte di un dispositivo planare rimane limitata (restringendo fortemente il campo visivo) e anche la risoluzione spaziale è circa un ordine di grandezza inferiore a quella ottenuta naturalmente dalla retina in corrispondenza della macula.
Per queste ragioni, abbiamo recentemente sviluppato una retina artificiale di seconda generazione, “liquida”, microiniettabile e ad alta risoluzione che consiste in una sospensione di nanoparticelle polimeriche fotoattive di dimensione sub-micrometrica. La stimolazione luminosa delle nanoparticelle provoca l’attivazione dei neuroni retinici interni risparmiati dalla degenerazione, mimando così il processo cui sono deputati i fotorecettori retinici.
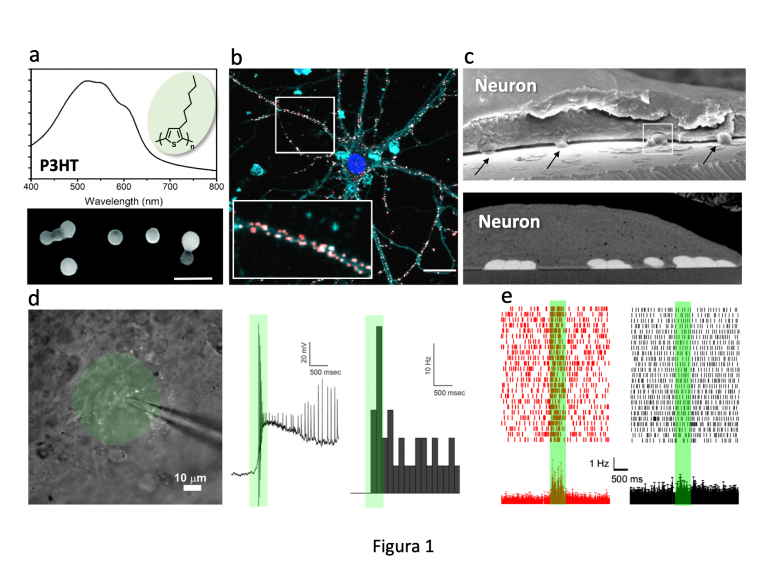
a. Spettro di assorbimento del P3HT e NP ottenute con il metodo della riprecipitazione (scala, 1 µm). b. NP (rosso) decorano i processi neuronali (scala, 10 µm). c. Intimo contatto tra NP (frecce) e membrana neuronale rivelato al microscopio elettronico che permette l’effetto capacitivo di fotostimolazione. d,e. Eccitazione di un neurone ganglionare retinico appartenente a una retina cieca in seguito all'esposizione delle NP alla luce visibile (registrazioni current-clamp in pannello d e con matrici di microelettrodi in pannello e). La stimolazione luminosa è rappresentata dalla banda verde.
I risultati sperimentali rivelano che a seguito della microiniezione, le nanoparticelle diffondono in tutto lo spazio subretinico e inducono l’attivazione luce-dipendente della retina, promuovendo un completo recupero della visione (Nature Nanotechnology 2020, 15: 698-708). Tale recupero delle funzioni visive, che persiste per lungo dopo una singola iniezione, ha un’elevata potenzialità per la terapia delle distrofie retiniche nell’uomo, come Retinite pigmentosa e la molto più frequente degenerazione maculare legata all’invecchiamento
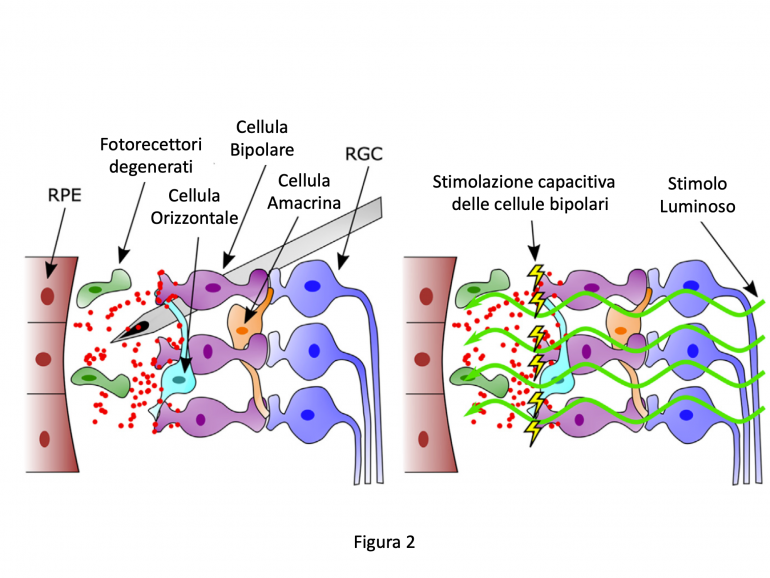
Le NP vengono iniettate nello spazio sottoretinico di ratti Royal College of Surgeons con degenerazione dei fotorecettori (RPE, epitelio pigmentato retinico; RGC, cellule ganglionari retiniche). Dopo l'illuminazione con luce visibile, le superfici delle NP acquisiscono una carica negativa, stimolando le cellule bipolari tramite un meccanismo capacitivo e permettendo la stimolazione delle cellule ganglionari e l’invio delle informazioni visive al cervello con il nervo ottico
Le ricerche sulle molecole fotocromatiche artificiali
Un’altra strategia per modulare la l’attività neuronale con la luce riguarda la generazione di nanoattuatori che alterino le proprietà elettriche della membrana. L'adagio “la forma si adatta alla funzione” è un elogio alla biologia strutturale che suggerisce un ruolo dinamico di macchine molecolari in grado di cambiare forma in seguito a uno stimolo. Il retinale, il cromoforo dei fotorecettori, ne è un buon esempio. La foto-isomerizzazione del retinale dalla forma cis alla forma trans provoca una lunga cascata di processi che portano alla percezione visiva. Nel tentativo di imitare la natura, le molecole fotocromatiche artificiali sono state ampiamente studiate come interruttori biologici in una varietà di situazioni.
In un recente studio (Nature Nanotechnology 2020, 15: 296-306) abbiamo dimostrato che una molecola fotocromatica anfifilica di nuova concezione (Ziapina) inserisce nella membrana dei neuroni e rende i neuroni stimolabili dalla luce attraverso un effetto fotomeccanico generato da una perturbazione della membrana cellulare che ne cambia le caratteristiche elettriche.
La Ziapina contiene componenti idrofobici e polari su lati opposti del gruppo fotosensibile dell’azobenzene che la fanno inserire nel doppio strato lipidico della membrana, mantenendo il terminale polare esposto sulla superficie della membrana. Due molecole di Ziapina disposte sui lati opposti della membrana formano un dimero che riduce localmente lo spessore della membrana, con conseguente aumento della capacità elettrica (la capacità di immagazzinare cariche).
In seguito a stimoli luminosi, il cambiamento conformazionale dell'azobenzene fa cessare dimerizzazione della Ziapina, producendo il rilassamento della membrana al suo spessore originario. In altre parole, l'attività push-pull della Ziapina sullo spessore della membrana fa oscillare la membrana da uno stato di alta a uno stato di bassa capacità elettrica.
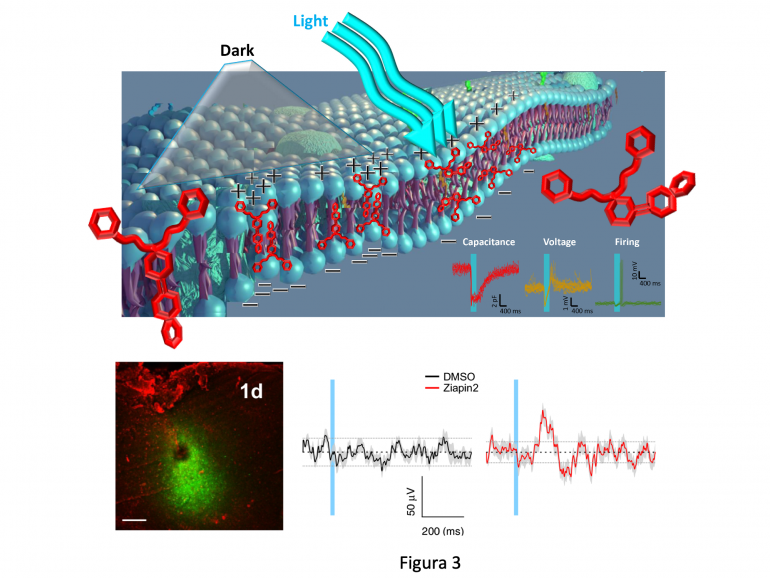
Pannello superiore: Meccanismo d’azione della Ziapina. La Ziapina (struttura rossa) contiene componenti idrofobici e polari su lati opposti del gruppo fotosensibile dell’azobenzene che la fanno inserire nel doppio strato lipidico della membrana. Coppie di Ziapina in trans formano un dimero che riduce localmente lo spessore della membrana, con conseguente aumento della capacità. In seguito a stimoli luminosi, il cambiamento conformazionale della Ziapina fa cessare la dimerizzazione, producendo il rilassamento della membrana e una rapida diminuzione di capacità. Questa induce un transiente di voltaggio che porta alla generazione di potenziali d’azione (tracce in basso a destra). Pannello inferiore: Effetto dell’iniezione intracerebrale di Ziapina (area fluorescente nel pannello a sinistra) sull’attività elettrica corticale indotta dalla luce (pannello a destra). Iniezione del veicolo (DMSO) è stata utilizzata come controllo. La stimolazione luminosa è rappresentata dalla banda azzurra.
La capacità svolge un ruolo chiave di regolazione del comportamento elettrico dei neuroni: lo stato di alta capacità della membrana in assenza di luce rende il neurone meno incline a cambiare il suo potenziale, riducendo così la sua eccitabilità mentre, sotto l’azione della luce, la diminuzione della capacità innesca rapide variazioni del potenziale di membrana che portano all'attivazione di potenziali d'azione.
La Ziapina è pertanto una sorta di “nanomacchina” a due facce, che mantiene i neuroni silenti al buio e scatena la loro attività sotto il comando della luce. La sua duplice attività la rende utile potenzialmente per contrastare l’eccessiva eccitabilità dei circuiti neuronali presente in caso di epilessia e, allo stesso tempo, di comandare, mediante la luce, l’attivazione dei neuroni retinici nelle patologie degenerative della retina o di specifiche aree cerebrali coinvolte nella patogenesi di malattie neurologiche.
Le innovative strategie di fotostimolazione neuronale che abbiamo sviluppato, oltre a non implicare trasformazioni geniche, rappresentano una valida alternativa ai metodi utilizzati fino ad oggi per ripristinare la capacità fotorecettiva dei neuroni retinici con una potenziale elevata risoluzione spaziale.
Lo sviluppo di questi nano-materiali fotosensibili apre la strada a potenziali applicazioni basate sulla foto-stimolazione neuronale nel campo della medicina. Non solo ci permetteranno di conquistare, in un futuro non molto lontano, una maggiore conoscenza della fisiologia del cervello, ma potranno essere impiegate per la terapia delle malattie degenerative della retina, come la retinite pigmentosa o di disfunzioni cerebrali come l’epilessia e il morbo di Parkinson.
Foto di copertina di Gerd Altmann da Pixabay