Una svolta cruciale nella terapia della malattia di Alzheimer
L’approvazione di aducanumab da parte della FDA
Il 7 di giugno 2021 la Food and Drug Administration (FDA) ha approvato attraverso una procedura accelerata l’aducanumab (AduhelmTM) come terapia per la malattia di Alzheimer (AD), essendo in grado di ridurre l’accumulo di placche formate dalla proteina beta amiloide nel cervello dei pazienti affetti da tale malattia.
Nei trials clinici recentemente effettuati l’aducanumab riduce l’accumulo di beta amiloide del 59-71% rispetto ai casi trattati con placebo e l’FDA, contestualmente alla approvazione, raccomanda alla Biogen, la casa produttrice dell’anticorpo monoclonale, di continuare nello sviluppo clinico della molecola, al fine di dimostrare in maniera convincente che la diminuzione dell’accumulo di amiloide è seguita anche da un miglioramento dei disturbi clinici della malattia, come la memoria, le funzioni esecutive, l’orientamento e più in generale le funzioni cognitive.
La malattia di Alzheimer
La malattia di Alzheimer (AD) è la forma di demenza più frequente. Circa il 5-6 % delle persone sopra i 65 anni hanno un decadimento cognitivo e su 10 persone che hanno un decadimento mentale circa 6 hanno una AD.
In Italia sono almeno 1 milione le persone affette da AD che si caratterizza per la presenza di disturbi della memoria, del linguaggio, delle funzioni visuo-spaziali, della critica, del giudizio e del comportamento, fino ad arrivare nel giro di alcuni anni a una forma grave di demenza, con necessità di assistenza continua per compiere i comuni atti della vita. E’ una patologia età correlata, responsabile di grande sofferenza personale e familiare, che è andata aumentando nel tempo per l’aumento della sopravvivenza nella popolazione generale.
La causa della AD è legata all’accumulo nel cervello, a sede extraneuronale, di una proteina anomala che si chiama beta amiloide e dalla presenza nei neuroni di un’altra proteina abnormemente fosforilata denominata proteina tau (le placche senili extracellulari e le degenerazioni neurofibrillari intracellulari, vedi figura sotto).
La presenza di tali sostanze determina un effetto tossico sull’encefalo, con morte e perdita neuronale, alterazioni delle connessioni fra i neuroni (sinapsi) e alla fine atrofia cerebrale e quindi perdita di funzione. Si ritiene che l’evento primario sia la deposizione di beta amiloide che avviene lentamente nel tempo, iniziando anche molti anni prima dell’esordio clinico, e che tale deposizione di amiloide sia seguita dalla comparsa della proteina tau iperfosforilata nelle cellule nervose e dalla degenerazione del tessuto circostante.
Tuttavia questa ipotesi patogenetica (teoria della cascata della amiloide) non è condivisa da tutti gli studiosi, poiché il rapporto fra amiloide e tau non è così chiaro, e sequenziale, si può avere accumulo di amiloide anche in assenza di demenza e molte forme di demenza non Alzheimer non presentano amiloide a livello cerebrale.
L’amiloide deriva da una proteina diffusamente presente nel sistema nervoso centrale, l’amiloid precursor protein (APP), che viene normalmente tagliata e metabolizzata attraverso diversi enzimi o secretasi (α,β,e γ). Nell’AD la APP viene tagliata in maniera anomala e si accumulano peptidi formati da 40, 42 e 43 amminoacidi (la beta amiloide), prima solubili e poi insolubili e che precipitano nel tessuto cerebrale dando origine alle placche senili che esercitano la loro azione tossica sul tessuto circostante.
Fino a ora le uniche terapie approvate dalle autorità regolatorie per la AD sono sostanze in grado di aumentare la acetilcolina (un neurotrasmettitore che interviene nei processi di memoria) a livello cerebrale (inibitori della colinesterasi come donezepil o rivastigmina o galantamina) o antagonisti del recettore NMDA a cui si lega l’acido glutammico, un neurotrasmettitore eccitatorio del sistema nervoso (memantina).
Tali sostanze sono di modesto effetto sintomatico e non interferiscono affatto con la cascata patogenetica della malattia.
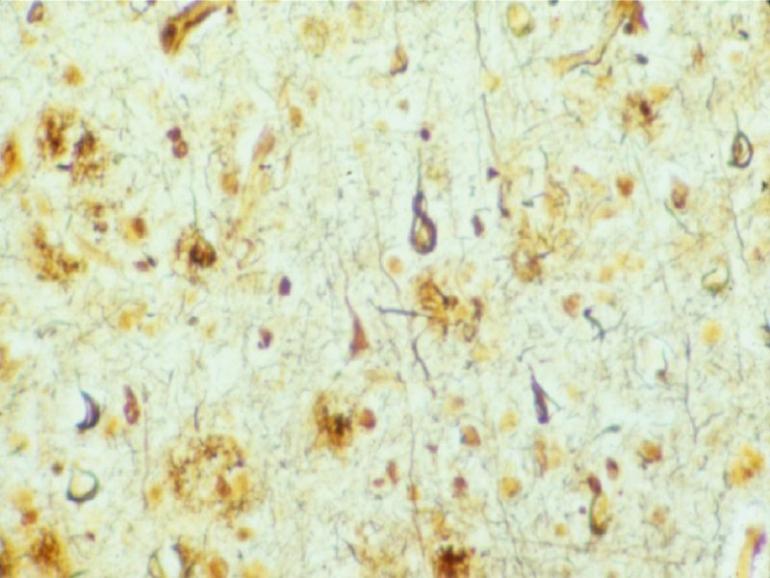
Placche senili e degenerazioni neurofibrillari in corteccia temporale
Ridurre il deposito di amiloide
Chiaramente ridurre il deposito di amiloide potrebbe avere un effetto positivo sulla malattia. Molti tentativi sono stati fatti per ridurre la produzione di beta amiloide, impedire la sua aggregazione, o facilitare il suo smaltimento.
Negli ultimi anni si è visto che è possibile indurre la produzione di anticorpi anti-amiloide attraverso una immunizzazione attiva o anche attraverso la somministrazione passiva di anticorpi monoclonali. Questi anticorpi monoclonali sono in grado di legare diverse forme di beta amiloide e diminuirne quindi la concentrazione a livello cerebrale.
Per quanto riguarda l’aducanumab, che è un anticorpo monoclonale ricombinante che si lega agli aggregati solubili e insolubili di amiloide e che proviene da una libreria di linfociti raccolti da donatori sani privi di decadimento cognitivo, è in grado di ridurre l’accumulo dell’amiloide nell’animale. Nell’uomo sono stati fatti alcuni studi che hanno confermato la sua capacità di ridurre il deposito della amiloide, ma gli effetti clinici sul rallentare il decadimento mentale sono stati meno chiari (studi Prime, Engage e Emerge), anche se pazienti che avevano ricevuto dosi più elevate e che avevano effettuato il farmaco per più tempo sembravano evidenziare un rallentamento della progressione del declino cognitivo.
Il farmaco non è però totalmente privo di effetti collaterali e può in alcuni casi causare reazioni allergiche o cefalea, vertigini, confusione mentale, dovuti a piccole alterazioni della barriera emato-encefalica o piccole emorragie, visibili alla Risonanza Magnetica.
Quindi non esistono ancora certezze assolute sull’efficacia clinica dell’aducanumab, anche se, incidendo profondamente sul deposito di amiloide, è possibile che, se usato nelle fasi molto inziali di malattia, possa determinare anche significative ricadute cliniche positive.
L’approvazione da parte della FDA di un farmaco per l’AD in grado certamente di ridurre il deposito di una proteina considerata cruciale per lo sviluppo della malattia è un atto molto significativo e che apre comunque delle prospettive impensabili solo pochi anni fa (nulla sarà come prima).
Ora è necessario condurre gli studi clinici che ne dimostrino inequivocabilmente l’efficacia, sia su aducanumab sia su molecole simili, e avere al più presto il parere dell’Autorità Regolatoria Europea (EMA).
Nel frattempo è necessario migliorare la assistenza sanitaria alle persone con decadimento cognitivo, potenziando i Centri per i disturbi cognitivi e le demenze (CDCD), le neurologie e le geriatrie, le medicine nucleari (indispensabili per diagnosticare con certezza l’accumulo di amiloide mediante PET cerebrale) e le strutture che dovranno gestire la terapia e la rieducazione per le persone con decadimento cognitivo.
Bibliografia
- Press release by Biogen and Eisai: FDA grants accelerated approval for ADUHELM™ as the first and only Alzheimer’s disease treatment to address a defining pathology of the disease; June 7, 2021
- Decourt B, Boumelhem F, Pope ED 3rd, Shi J, Mari Z, Sabbagh MN. Critical appraisal of amyloid lowering agents in AD. Curr Neurol Neurosci Rep. 2021 Jun 10;21(8):39. doi: 10.1007/s11910-021-01125-y.
Gianluigi Mancardi è Docente di Neurologia presso il DINOGMI
Flavio Mariano Nobili è Docente di Neurologia presso il DINOGMI
Foto di copertina d