La risposta all’immunoterapia contro il cancro può dipendere dai geni con cui siamo nati
Immunoterapia: una scoperta rivoluzionaria
L'approccio terapeutico basato sul potenziamento del sistema immunitario ha cambiato il modo in cui viene trattato il cancro. Questo metodo rivoluzionario rappresenta una delle maggiori scoperte nella medicina moderna perché può indurre una remissione duratura in alcuni pazienti con tumore avanzato e, in alcuni casi, eliminare completamente il tumore.
Nel 2018, lo statunitense James P. Allison e il giapponese Tasuku Honjo si aggiudicarono il Premio Nobel per la medicina per la loro scoperta della terapia del cancro mediante l'inibizione della regolazione immunitaria negativa.
Ma solo una minoranza di pazienti risponde a tale trattamento.
Negli ultimi 5 anni gli scienziati hanno scoperto che i tumori che hanno già un'infiltrazione di un certo tipo di cellule immunitarie rispondono meglio all'immunoterapia. Purtroppo, non esistono marcatori in grado di predire accuratamente chi risponderà a questa terapia.

Genetica e risposta immunitaria anticancro
Sorge una domanda: perché alcuni pazienti sviluppano questa immunità anticancro spontanea, ma parziale, che li renderà più propensi a rispondere all'immunoterapia? Sappiamo che il nostro rischio di sviluppare il diabete o di avere la pressione alta è influenzato dalla nostra genetica. Succede lo stesso con la risposta immunitaria anticancro?
La ricerca pubblicata su Immunity
"Germline genetic contribution to the immune landscape of cancer" è il titolo dell'articolo pubblicato su Immunity (CellPress), una delle principali riviste scientifiche al mondo, relativo alla ricerca sviluppata da un team internazionale guidato da Davide Bedognetti (docente di medicina interna dell'Università di Genova e Direttore del Cancer Program presso Sidra Medicine in Doha – Qatar) e da Elad Ziv (docente di medicina presso UCSF University of California, San Francisco – USA).
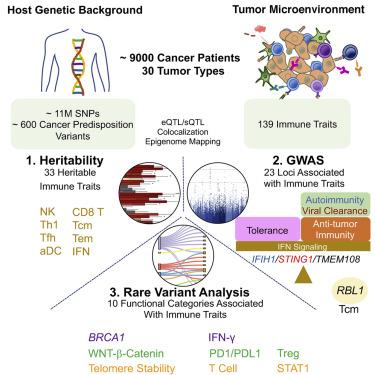
Gli scienziati hanno scoperto che l'immunità anticancro preesistente dipende fortemente dal background genetico dei pazienti. In altre parole, alcune varianti genetiche che rendono ognuno di noi unico, possono anche influenzare il modo in cui il sistema immunitario combatte i tumori.
In particolare, gli autori hanno scoperto che una variazione considerevole dell'infiltrazione immunitaria nel tumore è influenzata dai geni del soggetto e hanno identificato i geni e le varianti chiave responsabili di questo fenomeno. Tra questi, ci sono i geni della via dell'interferone, un meccanismo che viene attivato anche durante la risposta antivirale e, in modo aberrante, in alcune malattie autoimmuni.
Il team ha identificato varianti in 22 regioni del genoma con effetti immunomodulatori, incluse varianti del gene IFIH1, che sono state precedentemente associate a malattie autoimmuni; varianti che predispongono al diabete mellito di tipo 1, per esempio, si associano a un tumore più immunogenico. Altre varianti importanti sono state identificate nel gene STING, responsabile della produzione di interferone, una molecola con attività antivirale e antitumorale. Il team ha scoperto che alcune persone hanno una variante che li rendi incapaci di attivare pienamente la via dell’interferone, il che potrebbe portare a un'ulteriore stratificazione dei pazienti per sapere chi potrebbe trarre maggior beneficio da terapie innovative, ad esempio usando agonisti di STING, che sono attualmente in studio.
La ricerca ha richiesto l’analisi di un'enorme quantità di dati relativi a pazienti, con tumori, arruolati dal Cancer Genome Atlas (TCGA). Sono state analizzate le informazioni genetiche e fenotipiche relative a 9.000 pazienti con 30 diversi tipi di cancro. Il team scientifico internazionale composto da immunologi, oncologi, genetisti e bioinfomatici ha esaminato quasi 11 milioni di varianti geniche e valutato la loro correlazione con 139 parametri immunitari derivati da complesse analisi genomiche effettuate sui campioni tumorali.
Quali prospettive nella cura?
I passi successivi della ricerca porteranno a creare punteggi immunogenetici (polygenic risk score) per individuare i pazienti con maggiore probabilità di rispondere all’immunoterapia e a comprendere appieno il meccanismo d'azione dei nuovi geni per sviluppare terapie personalizzate più efficaci. “Siamo ancora all’inizio, ma questo è quello che speriamo di ottenere”, dice Bedognetti.
L'articolo è pubblicato su Immunity (VOLUME 54, ISSUE 2, P367-386.E8, FEBRUARY 09, 2021).
DOI: https://doi.org/10.1016/j.immuni.2021.01.011
